为推进仿制药一致性评价工作,总局自2017年3月17日,分批次陆续公布仿制药参比制剂目录,并于2019年3月28日开始公示仿制药参比制剂目录征求意见稿。
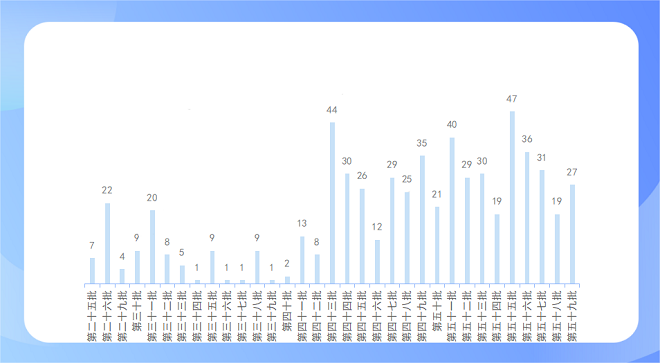
在《化学仿制药参比制剂目录(第二十五批)(征求意见稿)》中开始更新未通过审议品种目录,截止至《化学仿制药参比制剂目录(第五十九批)(征求意见稿)》,已更新了620个未通过审议的品规,93个为收到企业提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。
下图为征求意见稿历史批次未通过审议参比公布情况:
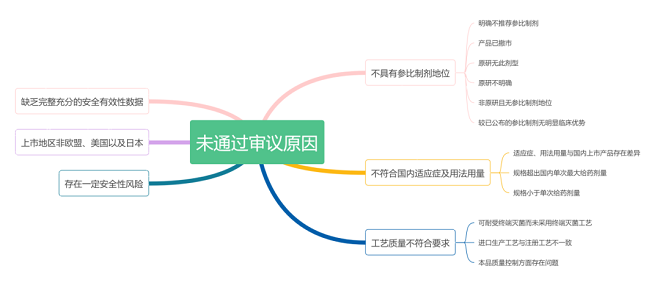
未通过审议的主要原因如下:
A不具参比制剂地位
根据《化学仿制药参比制剂遴选与确定程序》,我们选择参比制剂的顺序依次为:原研进口、未进口原研、原研地产化和国际公认的同种药物。
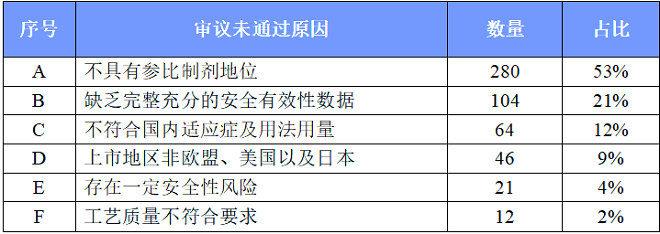
527个未通过审议的品规中,其中有280个是因为不具参比制剂地位而遭到否定。对不具参比制剂地位的原因进行分析,还可以分为以下几种情形:
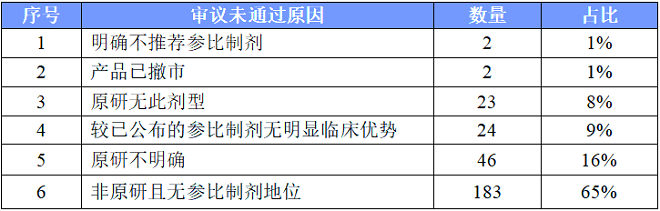
1.明确不推介参比制剂
国家局发布的关于可豁免或简化人体生物等效性(BE)试验品种明确不推介参比制剂。例如复方聚乙二醇电解质散(V),同类品种已在国家局发布的关于可豁免或简化人体生物等效性(BE)试验品种(第二批)的通告(2018年第136号)中,明确不推荐参比制剂。固未通过审议。
2. 原研无此剂型
因拟申报参比制剂为为改规格品种,原研无此规格而未通过审议,例如:阿卡波糖咀嚼片、泮托拉唑钠肠溶胶囊、对乙酰氨基酚干混悬剂、倍他米松磷酸钠注射液等。
3.较已公布的参比制剂无明显优势
3.1拟申请参比制剂与已发布参比制剂浓度相同,仅装量不同。
我们可以查到在第二十七批中公布了钆布醇注射液(Bayer Healthcare Pharmaceuticals )4.5354g/7.5ml的规格,在第二十八批中公布了9.0708g/15ml的规格。
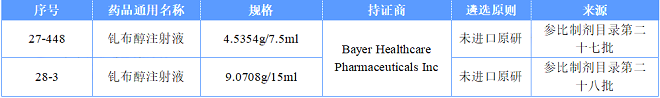
《化学仿制药参比制剂目录(第五十九批)(征求意见稿)》中,Bayer Healthcare Pharmaceuticals Inc的钆布醇注射液,1.20944g/2ml、6.0472g/10ml、18.1416g/30ml、39.3068g/65ml均遭到了否定,原因是与已发布参比制剂浓度相同,仅装量不同。
3.2已发布参比制剂为美国上市的处方药,不建议增加OTC药物作为参比制剂
奥美拉唑碳酸氢钠胶囊在美国按处方药和OTC分别管理,已发布参比制剂为美国上市的处方药,不建议增加OTC药物作为参比制剂。
3.3较已发布参比制剂无临床优势
大鵬薬品工業株式会社的注射用哌拉西林钠他唑巴坦钠,因粉液双室袋用途不广泛,且成本高,遭到否定;MSD株式会社的孟鲁司特钠口崩片,因拟申请剂型为口崩片,仅为临床提供一种剂型选择,与已上市其他口服制剂比较无临床应用优势,审议未通过;共和薬品工業株式会社的头孢氨苄细粒剂因已发布的头孢氨苄干混悬剂的参比制剂基本能覆盖儿童患者所需的用法用量,审议未通过。
3.4非原研且无参比制剂地位
Oceanside Pharmaceuticals的甲硝唑阴道凝胶,虽为原研授权仿制药,但其为美国上市的仿制药,不具有参比制剂地位;Teva Pharmaceuticals Usa Inc的普伐他汀钠片(4个规格),虽为国际公认的同种药品,但拟申请参比制剂为美国上市的仿制药,不具有参比制剂地位,审议未通过。
B 缺乏完整充分的安全有效性数据
因缺乏完整充分的安全有效性数据而审议未通过的品规共104个,其中有22个收到企业提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。
该类未通过审议的原因,多为申请人提供的安全性和有效性数据不够充分,无法确定其为确定具有安全性、有效性和质量可控性的药品。除此之外,Alfasigma Romania S.R.L.的注射用磷酸肌酸钠为国内上市的原研药品,但本品已纳入《第一批国家重点监控合理用药药品目录》,相关安全有效性数据有限,审议未通过;Polichem S.R.L.的匹多莫德口服溶液,根据《总局关于匹多莫德口服液启动临床有效性试验的通知》食药监药化管函〔2018〕31号,临床有效性证据不足,审议未通过;Alfasigma S.p.A.的盐酸乙酰左卡尼汀肠溶片,原研曾申报进口,其申报资料尚不足以支持本品对于所申请适应症的有效性,结论为不批准,审议未通过。
C 不符合国内适应症及用法用量
因不符合国内适应症及用法用量的共涉及64个品规。细分为以下三个原因:

武田薬品工業株式会社/あすか製薬株式会社的缩宫素注射液规格为1单位/ml,该品种1单位/ml规格不合理,小于说明书推荐单次使用最小剂量(2.5单位/ml);TAKEDA PHARMACEUTICALS USA INC的盐酸吡格列酮片的规格为45mg,既往降糖药物召开专家咨询会,临床专家反映本品国内应用最大剂量通常为30mg,拟申请参比制剂规格大于最大给药剂量,审议未通过;萘普生在国内为非主流非甾体抗炎药,Horizon Medicines LLC的萘普生艾司奥美拉唑镁肠溶片,复方暂不符合国内临床实践及复方制剂的要求,审议未通过。
D. 上市地区非欧盟、美国以及日本(监管体系较为完善)等地
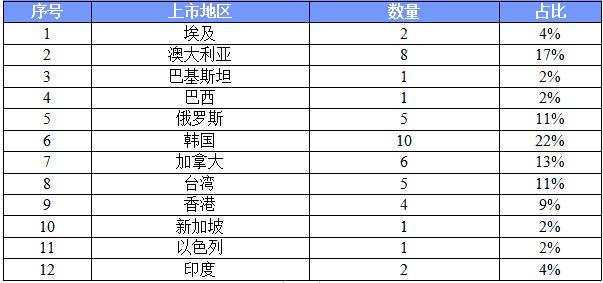
因上市地区非欧盟、美国以及日本等地而被否的品规共46个,为确保参比制剂的质量,建议参比制剂首选欧盟、美国以及日本等监管体系较为完善的机构批准上市的原研药品,审议未通过。
审议未通过的上市地区主要有以下12个:
E 存在一定的安全风险
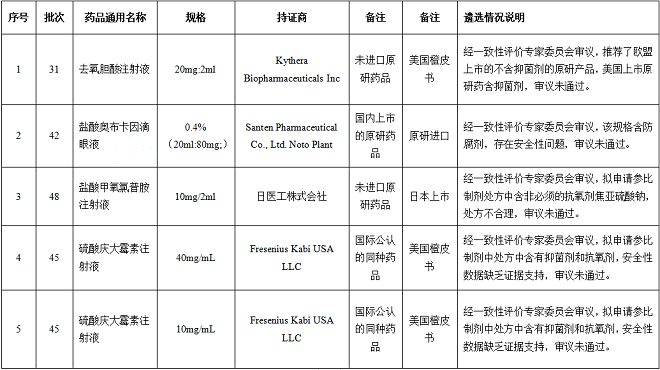
因存在一定的安全风险而未通过的品规共21个,其中有8个收到企业提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。
其中值得注意的是,注射剂、滴眼剂中,不添加防腐剂和抗氧剂的,更有优势成为参比制剂。
F 工艺质量不符合要求
因工艺质量不符合要求而未通过的品规共12个,其中有4个收到企业提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。
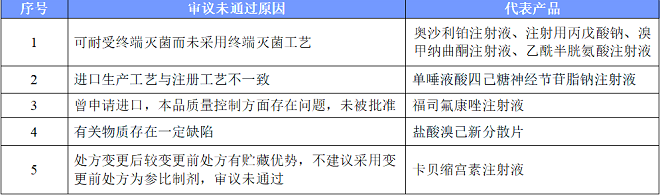
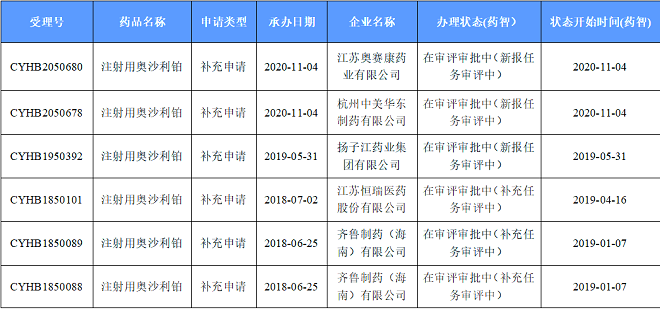
Sanofi-Aventis France的注射用奥沙利铂为第二十七批公布的参比制剂,经一致性评价专家委员会审议,拟调出参比制剂因采用终端灭菌工艺制备的奥沙利铂注射液可以满足产品杂质控制及稳定性要求,奥沙利铂注射剂应首选终端灭菌的注射液,注射用奥沙利铂为不合理剂型,予以调出。参比被否,已申报的产品已无获批的可能。
结语
参比制剂的选择,乃仿制药研发过程中的关键,如果选择错误,轻则延误项目进度,重则血本无归。通过研读参比制剂未通过审计的原因,可以汲取不少立项风险评估、产品调研方面的经验,清晰判断国家对仿制药的价值取向。我们在调研产品时,不能只关注国外的数据,更要关注药品在国内的表现。尽量避免申请参比制剂被驳回的尴尬,更要注意避免已选定参比制剂被调出目录的悲剧。