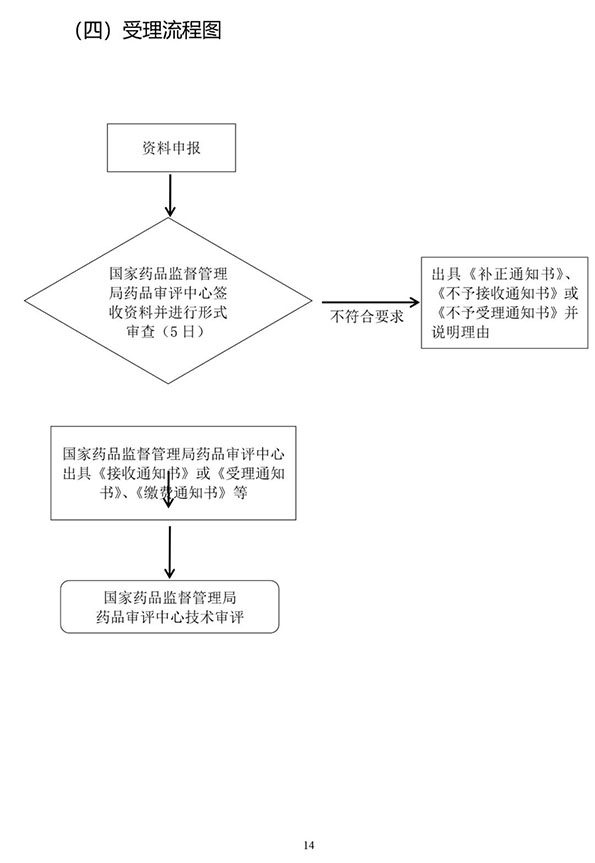
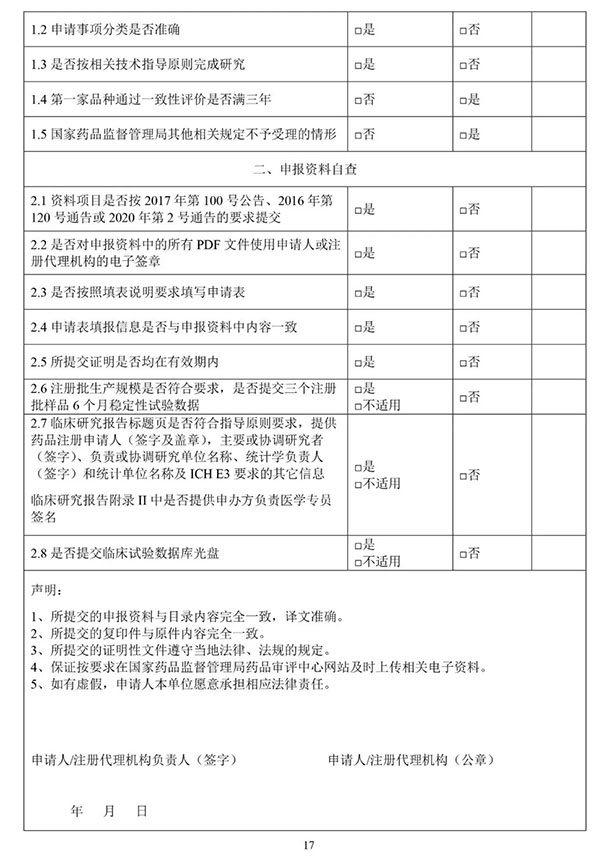
9月25日,国家药监局药审中心(CDE)在其官网公开征求《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》意见。
公示期限:自公示之日起一个月。
该征求意见稿是CDE在《总局关于发布〈仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)〉和〈仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)〉的通告》(2017年第148号)的基础上,结合药品注册电子申报及注射剂一致性评价的相关要求来修订形成的。
图片来源:CDE官网
关于公开征求《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》意见的通知
发布日期:20230925
为落实药品审评审批制度改革要求,贯彻实施《药品管理法》、《药品注册管理办法》、《药品上市后变更管理办法(试行)》的相关规定,药审中心在《总局关于发布〈仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)〉和〈仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)〉的通告》(2017年第148号)的基础上,结合药品注册电子申报及注射剂一致性评价的相关要求,修订形成《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》。现在中心网站予以公示,以广泛听取各界意见和建议。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并请及时反馈给我们,以便后续完善。感谢您的参与和大力支持!
公示期限:自公示之日起一个月
反馈意见邮件:yshchzhn@cde.org.cn
国家药品监督管理局药品审评中心
2023年9月25日